植物體內蛋白質氮測定的原理和步驟
植物體內的氮化物可分為蛋白質氮和非蛋白質氮兩大類。二者的含量和比例,隨著植物的生理狀況及環境條件的不同而發生變化。所以,測定兩類氮化物含量的變化動態,對研究植物在不同情況下,氮素的吸收、運轉和代謝規律,以及確定農產品的品質、營養價值等具有一定意義。
一、測定原理
在進行氮化物系統測定時,首先要將各類氮化物進行分離,分別消化,將非氨態氮轉變為氨態氮。然后,用測氨態氮的方法進行測定。
1.分離:用三氯乙酸浸提樣品時,蛋白質沉淀析出,而非蛋白質則熔解在三氯乙酸中,然后分別測定沉淀物及濾液中的氮量,即可求出蛋白氮和非蛋白氮的含量。’
2.消化:當植物材料與濃硫酸一起加熱時,硫酸分解成為二氧化硫、水和原子態氧,將有機物氧化分解生成二氧化碳和水。反應為:
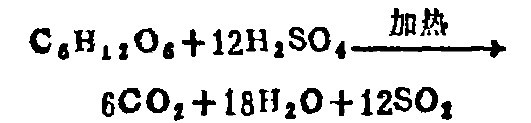
為了加速消化進程,加入硫酸鉀及還原性催化劑硫酸銅。硫酸鉀可大大提高氧化能力及增高硫酸的沸點。
二、測定步驟
1.分離提取:①在分析夭秤上準確稱取磨碎過篩的風干樣品0.1~0.5克(視含氮量而定),放入100毫升帶塞磨口三角瓶中,加20毫升吞萬的三氯乙酸,置振蕩機上振蕩提取一小時。然后用漏斗過濾,濾液直接漁入克氏瓶中,用三氯乙酸將三角瓶中樣品沖洗數次,每次用量10毫升,把樣品殘渣全部移入漏斗中,濾液全部濾入克氏瓶內(沖洗液最不要過多)。②將瓶內的濾液濃縮至3、5毫升,用以測定非蛋白氮.再將漏斗中沉淀連同濾紙一道放入另1個克氏瓶中,用以測定蛋白氮,并取同樣重量的嫩紙一張,放在第三個克氏瓶中,作空白測定。
2.消化:①向以上樣品及空白測定的克氏瓶中各加入濃硫酸3、6毫升,混合催化劑0.3、0.5克(如用比色法測定氮,消化時不必加催化劑,而用幼萬的過氧化氫促進載化)。加好后,蓋上小漏斗,浸泡樣品數小時或1夜。這樣,可以減少泡沫,防止外溢。②開始消化時火焰宜小,待有二氧化硫氣體出現后,逐漸升溫,使內容物達到曦沸。在消化過程中,瓶巾的顏色將發生以下的變化。黑、深棕一淺棕一黃一綠,藍綠在消化過程中,須經常轉動克氏瓶。當溶液變成淺棕色時,如果瓶璧還附有黑色傾拉時,可以將瓶適當揭動使黑粒洗下。繼續加熱。至溶液呈清亮的藍色后,再加熱10分鐘俏化完畢。此時樣品中的蛋白氮和非蛋白氮化物全部轉變為氨態氮。③待瓶冷卻后,向其中加10毫升蒸餾水,搖勻,并小心倒入10D毫升容量瓶中。再以少最燕餾水稀釋至刻度,混勻備用。
3.氮的測定:氮的測定可用KDN系列定氮儀法,也可以用次鹵酸氧化法成其它比色法。




