幾種測量飼料蛋白質含量的對比分析
生活很多地方需要進行蛋白質含量的測定,涉及到農林牧副漁等各個方面的內容,我們在進行測定的時候,最擔心的就是測定結果不準確,進而導致我們的后續工作開展不合理,即使是方法正確,也可能導致最后帶不來很好的收益,下面我們來看下幾種測量飼料蛋白質含量的對比分析,希望可以給大家帶來一些幫助。
蛋白質營養是動物營養的關鍵,是動物生長發育和生產的基礎,其含量是評價飼料營養品質的直接指標。測定飼料粗蛋白質含量是否快捷,關鍵在于樣品消化過程是否方便、省時。目前GB/T6432-1994規定了用硫酸銅作催化劑用濃硫酸進行消化,消化時間較長。本研究用濃硫酸和過氧化氫進行樣品消化,并將兩種消化方法得到的消化液進行測定,比較測得的粗蛋白質含量的差異。旨在探討一種粗蛋白測定的快速消化方法,以便滿足飼料企業需要快速獲得樣品及產品中粗蛋白質含量的要求,真正達到快速、廉價、高效、節能。
開始研究之前準備好下面的儀器和試劑:NPCa-02型氮、磷、鈣快速測定儀及四孔消化爐、實驗室用樣品粉碎機、分析天平、滴定管。試劑濃硫酸:(GB625)化學純;硫酸銅:(GB665)化學純;硫酸鈉:(HG3-920)化學純;鹽酸標準滴定液:0.05M鹽酸溶液;混合指示劑:甲基紅(分析純)1g•L-1乙醇溶液和溴甲酚綠(分析純)5g•L-1乙醇溶液等體積混合;硼酸吸收液:硼酸(化學純)10g•L-1溶液;40%氫氧化鈉溶液;30%過氧化氫。
采用的簡單消化方法:國標法、稱取樣品0.5-1g,準確至0.0002g,無損地放入消化管中,加入硫酸銅0.4g,硫酸鈉6g,與試樣混合均勻,再加入濃硫酸10mL和2粒玻璃珠。將消化管放入消化爐中小心加熱,待樣品焦化,泡沫消失,再加大火力使溫度達到360~410℃,直至溶液澄清后,再加熱消化15min。濃硫酸、過氧化氫法稱取樣品0.5-1g,準確至0.0002g,無損地放入消化管中,加入濃硫酸10mL,放入消化爐中,將消化爐電壓調至220V,消化至大量棕色煙冒出且消化液呈醬油色,取出消化管稍微冷卻后加入3~5mL過氧化氫,同時將消化爐電壓調至150~180V,并將消化管重新放入消化爐中消化2~35min,仍用上法,向消化管內滴入過氧化氫直至消化液幾乎無色,再移入消化爐中繼續消化5~10min取出,冷卻至室溫。氨的蒸餾:均采用半微量法進行蒸餾。
不同粗蛋白質含量的飼料產品的測定結果對魚配合飼料、豬濃縮料、乳豬配合飼料等6個樣品的粗蛋白質分別用兩種消化方法消化后進行測定,分別測定10次,測定結果見下表。
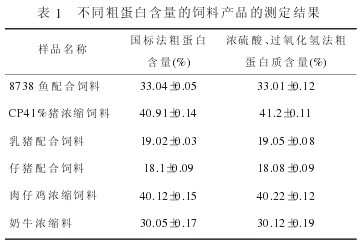
從表可見,對于不同飼料蛋白含量(CP18%~41%)的飼料產品而言,國標法所檢測到的粗蛋白質含量與濃硫酸、過氧化氫法測得的粗蛋白質含量相比無顯著差異。對于國標法中樣品的消化所用試劑量較小,價格相對偏低,但存在消化時間長,耗電多的缺點。一般樣品要達到要求需消化1~2h。而利用濃硫酸、過氧化氫方法進行消化,每個樣品消化只需30~40min即可。二者相比每次消化可以節約一半的時間。從檢測結果看,兩種消化方法對粗蛋白質的測定結果無顯著影響。目前,飼料中粗蛋白測定的國標法中消化使用濃硫酸,并用硫酸銅和硫酸鈉作催化劑。在濃硫酸、過氧化氫法未列入國標之前,飼料企業對于常規質檢可用此種消化方法,若遇到具有爭議性的結果,仍需采用國標法中的消化方法進行樣品消化和粗蛋白質測定。
所以,相對來說,我們在進行相關蛋白質含量測定的時候,應該考慮的如何進行測量才可以得出正確的結果,不能自己在進行養殖等生產的時候,直接在源頭上出現錯誤,使得自己的整個利用飼料進行養殖的計劃失敗。




